DECANTAÇÃO
http://edificacoesnoem.blogspot.com.br/2013/03/decantacao.html
CATAÇÃO
http://edificacoesnoem.blogspot.com.br/2013/03/catacao.html
CENTRIFUGAÇÃO
http://edificacoesnoem.blogspot.com.br/2013/03/centrifugacao.html
TIPOS DE FILTRAÇÃO
http://edificacoesnoem.blogspot.com.br/2013/03/filtracao-e-filtracao-vacuo.html
DISSOLUÇÃO FRACIONADA
http://edificacoesnoem.blogspot.com.br/2013/03/disolucao-fracionada.html
EVAPORAÇÃO
http://edificacoesnoem.blogspot.com.br/2013/03/evaporacao.html
DESTILAÇÃO SIMPLES
http://edificacoesnoem.blogspot.com.br/2013/03/destilacao-simples.html
DESTILAÇÃO FRACIONADA
http://edificacoesnoem.blogspot.com.br/2013/03/destilacao-fracionada.html
terça-feira, 5 de março de 2013
Destilação Fracionada
Destilação fracionada ou destilação fraccionada é o processo de separação onde se utiliza uma coluna de fracionamento na qual é possível realizar a separação de diferentes componentes que apresentam diferentes pontos de ebulição, presentes em uma mistura. Ela é um processo de rejuvenecimento, separação e loteamento dos produtos da mistura e é empregada quando os pontos de ebulição dos componentes de uma mistura são próximos e não é possível realizar uma destilação simples. Um aparelho mais complexo e que exige um pouco mais de tempo no processo.
Neste processo existe uma coluna de fracionamento que cria várias regiões de equilíbrio líquido-vapor, levando a uma série de microdestilações simples sucessivas, enriquecendo a fração do componente mais volátil da mistura na fase de vaporização.
Neste processo existe uma coluna de fracionamento que cria várias regiões de equilíbrio líquido-vapor, levando a uma série de microdestilações simples sucessivas, enriquecendo a fração do componente mais volátil da mistura na fase de vaporização.
Destilação Simples
A destilação simples serve para a separação de uma mistura homogênea de sólido e líquido, como NaCl e H2O, por exemplo. É importante que os pontos de ebulição das duas substâncias sejam bastante diferentes. A solução é colocada em um balão de destilação, feito de vidro com fundo redondo e plano, que é esquentado por uma chama. A boca do balão é tampada com uma rolha, junto com um termômetro. O balão possui uma saída lateral, inclinada para baixo, na sua parte superior. Nessa saída é acoplado o condensador.
O condensador é formado por um duto interno, onde em volta desse duto passa água fria corrente. Esse duto desemboca em um béquer ou erlenmeyer.
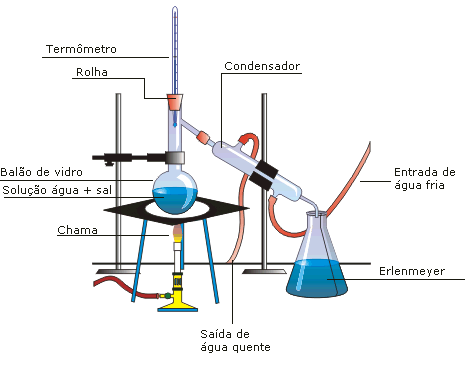
Processo de destilação
A solução no balão é esquentada, até que o líquido com menor ponto de ebulição comece a evaporar. Ao evaporar, ele só tem o condensador como caminho a seguir. As paredes do condensador são frias, pois a sua volta passa água fria. Ao entrar em contato com essas paredes frias, o vapor se condensa, retornando ao estado líquido. Após algum tempo, todo o líquido de menor ponto de ebulição terá passado para o béquer, e sobrará a outra substância, sólida, no balão de vidro.
O condensador é formado por um duto interno, onde em volta desse duto passa água fria corrente. Esse duto desemboca em um béquer ou erlenmeyer.

Processo de destilação
A solução no balão é esquentada, até que o líquido com menor ponto de ebulição comece a evaporar. Ao evaporar
Evaporação
A evaporação é um fenômeno no qual átomos ou moléculas no estado líquido (ou sólido, se a substância sublima) ganham energia suficiente para passar ao estado vapor.
O movimento térmico de uma molécula de líquido deve ser suficiente para vencer a tensão superficial e evaporar, isto é, sua energia cinética deve exceder o trabalho de coesão aplicado pela tensão superficial à superfície do líquido. Por isso, a evaporação acontece mais rapidamente a altas temperaturas, a altas vazões entre as fases líquida e vapor e em líquidos com baixas tensões superficiais (isto é, com pressões de vapor mais elevadas).
Como apenas uma proporção pequena de moléculas está localizada perto da superfície e movendo-se na direção correta para escapar do líquido em um certo instante, a taxa de evaporação é limitada. Além disso, como as moléculas de maior energia escapam e as que ficam têm menor energia cinética média, a temperatura do líquido diminui. Este fenômeno também é chamado de resfriamento evaporativo. Um exemplo para tal fenômeno é a transpiração (suor). A evaporação promove resfriamento porque consome calor sensível e o transforma em calor latente, consumindo, no caso da água, cerca de 600 calorias por grama (600 Kilocalorias por quilo) de água evaporada (inversamente, durante a condensação da água, ocorre a recuperação do calor sensível - também 600 calorias por grama).
Equilíbrio Evaporativo
Se a evaporação ocorrer em um recipiente fechado, as moléculas que escapam do líquido acumulam-se na forma de vapor acima do líquido. Muitas dessas moléculas, aliás, retornam ao líquido. Quando o processo de escape e retorno alcança um equilíbrio, o vapor é chamado de saturado, e não ocorrem mudanças adicionais na pressão de vapor ou na temperatura do líquido.
A razão entre a perda de calor de uma superfície de água por evaporação e a perda de calor devido à convecção, independente da velocidade do vento, é dada por:[3]
 é a perda de calor de uma superfície de água por convecção em W/(m²•K),
é a perda de calor de uma superfície de água por convecção em W/(m²•K), 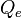 é a perda de calor de uma superfície de água por evaporação em W/(m²•K),
é a perda de calor de uma superfície de água por evaporação em W/(m²•K),  e
e  são as temperaturas da água e do ar em Kelvin (ou Celsius) e
são as temperaturas da água e do ar em Kelvin (ou Celsius) e  e
e  são as pressões do vapor da superfície da água e do ar e
são as pressões do vapor da superfície da água e do ar e 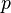 é a pressão barométrica, com todas pressões em mmHg (Bowen, 1926).
é a pressão barométrica, com todas pressões em mmHg (Bowen, 1926).
O movimento térmico de uma molécula de líquido deve ser suficiente para vencer a tensão superficial e evaporar, isto é, sua energia cinética deve exceder o trabalho de coesão aplicado pela tensão superficial à superfície do líquido. Por isso, a evaporação acontece mais rapidamente a altas temperaturas, a altas vazões entre as fases líquida e vapor e em líquidos com baixas tensões superficiais (isto é, com pressões de vapor mais elevadas).
Como apenas uma proporção pequena de moléculas está localizada perto da superfície e movendo-se na direção correta para escapar do líquido em um certo instante, a taxa de evaporação é limitada. Além disso, como as moléculas de maior energia escapam e as que ficam têm menor energia cinética média, a temperatura do líquido diminui. Este fenômeno também é chamado de resfriamento evaporativo. Um exemplo para tal fenômeno é a transpiração (suor). A evaporação promove resfriamento porque consome calor sensível e o transforma em calor latente, consumindo, no caso da água, cerca de 600 calorias por grama (600 Kilocalorias por quilo) de água evaporada (inversamente, durante a condensação da água, ocorre a recuperação do calor sensível - também 600 calorias por grama).
Equilíbrio Evaporativo
Se a evaporação ocorrer em um recipiente fechado, as moléculas que escapam do líquido acumulam-se na forma de vapor acima do líquido. Muitas dessas moléculas, aliás, retornam ao líquido. Quando o processo de escape e retorno alcança um equilíbrio, o vapor é chamado de saturado, e não ocorrem mudanças adicionais na pressão de vapor ou na temperatura do líquido.
[editar] Evaporação da água
É um erro dizer que somente existe vapor d'água a 100 °C a 1 atm. As moléculas de água estão em um estado constante de evaporação e condensação perto da superfície da água líquida.[2] Se uma molécula na superfície da água recebe energia suficiente, ela deixará o líquido, com formação de vapor a uma certa pressão. A uma pressão de vapor de 1 atm, a água acaba fervendo, e isto ocorre a 100 °C.A razão entre a perda de calor de uma superfície de água por evaporação e a perda de calor devido à convecção, independente da velocidade do vento, é dada por:[3]
 é a perda de calor de uma superfície de água por convecção em W/(m²•K),
é a perda de calor de uma superfície de água por convecção em W/(m²•K), 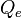 é a perda de calor de uma superfície de água por evaporação em W/(m²•K),
é a perda de calor de uma superfície de água por evaporação em W/(m²•K),  e
e  são as temperaturas da água e do ar em Kelvin (ou Celsius) e
são as temperaturas da água e do ar em Kelvin (ou Celsius) e  e
e  são as pressões do vapor da superfície da água e do ar e
são as pressões do vapor da superfície da água e do ar e 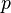 é a pressão barométrica, com todas pressões em mmHg (Bowen, 1926).
é a pressão barométrica, com todas pressões em mmHg (Bowen, 1926).
Disolução Fracionada
Dissolução fracionada é uma técnica ou método de processo de separação para separar misturas heterogêneas de dois ou mais sólidos, quando apenas um dos componentes se dissolve em um dado solvente.Pois, assim, o liquido dissolve esse componente e, por filtração, separa-se o outro componente. A seguir, através de uma evaporação do líquido usado, recupera-se o componente solúvel.
Exemplo
Temos uma mistura de sal mais areia e a ela adicionamos água aonde somente o sal irá se dissolver. Portanto, temos solução salina mais areia, uma mistura ou sistema heterogêneo, na qual em seguida será feita a filtração sendo a areia retida no papel de filtro. O filtrado, no caso a solução salina, passará por processo de evaporação ou destilação simples, isto é, a água líquida passará para o estado gasoso e o sal permanece no fundo do balão de destilação ou outro recipiente. '-'
Exemplo
Temos uma mistura de sal mais areia e a ela adicionamos água aonde somente o sal irá se dissolver. Portanto, temos solução salina mais areia, uma mistura ou sistema heterogêneo, na qual em seguida será feita a filtração sendo a areia retida no papel de filtro. O filtrado, no caso a solução salina, passará por processo de evaporação ou destilação simples, isto é, a água líquida passará para o estado gasoso e o sal permanece no fundo do balão de destilação ou outro recipiente. '-'
Filtração - Filtração a Vacuo - Funil de Separação
Filtração ou filtragem é um método para separar sólido de líquido ou fluido que está suspenso, pela passagem do líquido ou fluido através de um meio permeável capaz de reter as partículas sólidas. Existem filtrações de escala laboratorial e filtrações de escala industrial.
Numa filtração qualitativa, é usado o papel de filtro qualitativo, mas, dependendo do caso, o meio poroso poderá ser uma camada de algodão, tecido, polpa de fibras quaisquer, que não contaminem os materiais.
Para as filtrações quantitativas, usa-se geralmente papel filtro quantitativo, ou placas de vidro sinterizada ou de porcelana sinterizada.
Em qualquer dos casos indicados há uma grande gama de porosidades e esta deverá ser selecionada dependendo da aplicação em questão.
Tipos de Filtração
Existem basicamente 5 tipos de filtração utilizadas em laboratório, que são:
1. Filtrações Comuns de Laboratório
São onde os elementos fundamentais são: papel filtro qualitativo (comprado em rolos) e funil comum.
2. Filtração Analítica
Usada na análise quantitativa. O funil é o funil analítico, munido de um tubo de saída longo, que, cheio de líquido "sifona", acelerando a operação de filtração.
Os papéis filtro para fins quantitativos diferem dos qualitativos, principalmente por serem quase livres de cinzas (na calcinação), visto que, durante a preparação, são lavados com ácido clorídrico e fluorídrico, que dissolvem as substâncias minerais da pasta de celulose. O teor de cinza de um papel filtro quantitativo de 11 cm de diâmetro é menor que 0,0001 g. Eles existem no mercado na forma de discos ( = 5,5; 7,0; 9,0; 11,0; 12,5; 15,0 e 18,5) e com várias porosidades.
Os filtros de uma empresa são especificados pelo número 589 e tem várias texturas:
São as típicas filtrações a vácuo, pois são realizadas com a aplicação de vácuo para permitir, seja por motivo de tempo, seja por viscosidade do líquido a ser filtrado, necessitar-se de um diferencial de pressão (a própria pressão atmosférica atua como força) atuando sobre o líquido no filtro.
Filtração a vácuo
Substituindo-se o funil de Buchner por um cadinho de porcelana com fundo perfurado temos a filtração com cadinho de Gooch. É portanto, efetuada com sucção e o meio filtrante é polpa de papel de filtro quantitativo ou amianto.
Para a confecção do meio filtrante de amianto ou polpa de papel filtro, deve-se colocar o cadinho na alonga e adicionar com muito cuidado o amianto misturado com água (ou polpa de papel filtro com água). Bate-se levemente com a bagueta é deixa-se escorrer toda a água através de sucção. O meio filtrante não deve ser muito espesso.
4. Filtração em Cadinhos Com Placas Porosas de Vidro ou Porcelana
Neste caso, o cadinho já possui o meio filtrante fundido ao corpo do cadinho. Sofrem via de regia, ataque das soluções alcalinas. Por isso são utilizados em aplicações diversas, evitando-se apenas soluções francamente alcalinas.
5. Filtração à Quente
Quando a solubilidade permitir, a filtragem à quente é preferível, por reduzir a viscosidade do líquido.
Nas filtrações à quente, evita-se o contato do papel de filtro com as paredes do funil que resfriam o conjunto filtrante. Por isso, depois de feito o cone do papel, suas paredes são dobradas em pregas e aquece-se previamente o conjunto com água quente. Há também filtros com camisa de vapor e neste caso o papel filtro é adaptado como nos casos comuns. Filtração
A filtração é utilizada para realizar a separação do líquido de uma mistura sólido-líquido ou sólido-gasoso. O “equipamento” mais utilizado é o filtro de papel, usado para filtrar o café (um exemplo bastante prático do uso da filtração). Ele funciona como uma peneira microscópica, somente o líquido passa pelos seus minúsculos orifícios, acumulando a fase sólida dentro do filtro.
O nome dado á substância que passou pelo filtro é “filtrado”. O filtro é feito de fibras interlaçadas, formando uma peneira microscópica.
Num aspirador de pó, o filtro é utilizado para separar as partículas sólidas (poeira) do ar.
Numa filtração qualitativa, é usado o papel de filtro qualitativo, mas, dependendo do caso, o meio poroso poderá ser uma camada de algodão, tecido, polpa de fibras quaisquer, que não contaminem os materiais.
Para as filtrações quantitativas, usa-se geralmente papel filtro quantitativo, ou placas de vidro sinterizada ou de porcelana sinterizada.
Em qualquer dos casos indicados há uma grande gama de porosidades e esta deverá ser selecionada dependendo da aplicação em questão.
Tipos de Filtração
Existem basicamente 5 tipos de filtração utilizadas em laboratório, que são:
1. Filtrações Comuns de Laboratório
São onde os elementos fundamentais são: papel filtro qualitativo (comprado em rolos) e funil comum.
2. Filtração Analítica
Usada na análise quantitativa. O funil é o funil analítico, munido de um tubo de saída longo, que, cheio de líquido "sifona", acelerando a operação de filtração.
Os papéis filtro para fins quantitativos diferem dos qualitativos, principalmente por serem quase livres de cinzas (na calcinação), visto que, durante a preparação, são lavados com ácido clorídrico e fluorídrico, que dissolvem as substâncias minerais da pasta de celulose. O teor de cinza de um papel filtro quantitativo de 11 cm de diâmetro é menor que 0,0001 g. Eles existem no mercado na forma de discos ( = 5,5; 7,0; 9,0; 11,0; 12,5; 15,0 e 18,5) e com várias porosidades.
Os filtros de uma empresa são especificados pelo número 589 e tem várias texturas:
- a) Nº 589 - faixa preta (mole) - textura aberta e mole que filtra rapidamente. Usos: precipitados grossos e soluções gelatinosas.
- b) 589 - faixa branca (médio) - Usos: precipitados médios tipo BaSO4 e similares.
- c) 589 - faixa azul (denso) - Usos: precipitados finos como o do BaSO4 formado à frio.
- d) 589 - faixa vermelha (extra-denso) - Usos: para materiais que tendem a passar para a solução ou suspensões coloidais.
- e) 589 - faixa verde (extra-espesso) - Usos: no caso anterior quando exige-se dupla folha da faixa vermelha.
- f) 589-14 (fino) - Usos: filtração de hidróxidos do tipo hidróxido de alumínio e ferro.
São as típicas filtrações a vácuo, pois são realizadas com a aplicação de vácuo para permitir, seja por motivo de tempo, seja por viscosidade do líquido a ser filtrado, necessitar-se de um diferencial de pressão (a própria pressão atmosférica atua como força) atuando sobre o líquido no filtro.
- Funil de Buchner
Filtração a vácuo
Substituindo-se o funil de Buchner por um cadinho de porcelana com fundo perfurado temos a filtração com cadinho de Gooch. É portanto, efetuada com sucção e o meio filtrante é polpa de papel de filtro quantitativo ou amianto.
Para a confecção do meio filtrante de amianto ou polpa de papel filtro, deve-se colocar o cadinho na alonga e adicionar com muito cuidado o amianto misturado com água (ou polpa de papel filtro com água). Bate-se levemente com a bagueta é deixa-se escorrer toda a água através de sucção. O meio filtrante não deve ser muito espesso.
4. Filtração em Cadinhos Com Placas Porosas de Vidro ou Porcelana
Neste caso, o cadinho já possui o meio filtrante fundido ao corpo do cadinho. Sofrem via de regia, ataque das soluções alcalinas. Por isso são utilizados em aplicações diversas, evitando-se apenas soluções francamente alcalinas.
5. Filtração à Quente
Quando a solubilidade permitir, a filtragem à quente é preferível, por reduzir a viscosidade do líquido.
Nas filtrações à quente, evita-se o contato do papel de filtro com as paredes do funil que resfriam o conjunto filtrante. Por isso, depois de feito o cone do papel, suas paredes são dobradas em pregas e aquece-se previamente o conjunto com água quente. Há também filtros com camisa de vapor e neste caso o papel filtro é adaptado como nos casos comuns. Filtração
A filtração é utilizada para realizar a separação do líquido de uma mistura sólido-líquido ou sólido-gasoso. O “equipamento” mais utilizado é o filtro de papel, usado para filtrar o café (um exemplo bastante prático do uso da filtração). Ele funciona como uma peneira microscópica, somente o líquido passa pelos seus minúsculos orifícios, acumulando a fase sólida dentro do filtro.
O nome dado á substância que passou pelo filtro é “filtrado”. O filtro é feito de fibras interlaçadas, formando uma peneira microscópica.
Num aspirador de pó, o filtro é utilizado para separar as partículas sólidas (poeira) do ar.
Centrifugação
A centrifugação é um processo de separação em que uma amostra fluida é submetida a um aparelho centrifugador ou centrífuga a fim de se promover a separação dos componentes via sedimentação dos líquidos imiscíveis de diferentes densidades. É usada em diferentes aplicações laboratoriais, industriais e domésticas.
Princípio físico
É notório perceber que a maioria das explicações para o funcionamento das centrífugas figure em função da por muitos conhecida força centrífuga. Contudo é mais surpreendente perceber que tal explicação fundamenta-se em uma grandeza física sem realidade física, contudo: a chamada força centrífuga é uma pseudoforça ou força inercial, e por tal é fictícia, não existindo como força real, ou seja, como expressão da interação entre dois elementos físicos.
A compreensão do princípio de funcionamento das centrífugas passa antes portanto pela compreensão do que se denomina força inercial centrífuga e pela compreensão da não existência real de tal "força centrífuga", e a fim de evitar repetições de conteúdo, o leitor é dirigido ao artigo específico sobre o assunto.
Centrífugas ou centrifugadores
São equipamentos construídos de forma: colocando o recipiente contendo a amostra em movimento circular uniforme dotado de grande velocidade angular e raio apreciável. Objetiva submeter a amostra à situação em que uma grande força centrípeta é requerida à manutenção de sua trajetória.…
Em Biologia, Bioquímica e Química
A centrifugação é uma técnica fundamental usada em diversos ramos da Química, Biologia e Bioquímica para a separação de amostras. Em geral, estas são introduzidas em tubos de diferentes tamanhos, que são dispostos num motor de centrífuga. As centrífugas estão normalmente adaptadas para a utilização de diferentes tipos e tamanhos de rotores, conforme a velocidade e aplicação desejadas. Enquanto que microcentrífugas de bancada podem centrifugar tubos entre os 200 μL e os 2 mL de volume, centrífugas de grande porte podem usar tubos de volume muito variável, tipicamente até 1 L.
Separação de diferentes fases
Uma das aplicações mais frequentes da centrifugação é na separação de diferentes fases de uma amostra, em especial uma fase sólida de uma aquosa. Partículas insolúveis numa amostra sedimentam no fundo do tubo de centrífuga, restando o chamado sobrenadante (fase líquida) por cima do sedimento. O sobrenadante é então aspirado ou decantado e o sedimento retirado do tubo.
Esta técnica é usada, por exemplo, na separação de membranas celulares (insolúveis em água) e citoplasma (solvente celular aquoso) após ruptura de células. Também é usada para a separação dos elementos figurados do sangue e o plasma sanguíneo, em que as células (eritrócitos, leucócitos, plaquetas) são depositados no tubo, podendo o plasma ser separado e analisado.
Centrifugação diferencial
A centrifugação diferencial foi desenvolvida nos anos 60 do século XX por Christopher John Champerline e Juan Burdettee. Consiste em sujeitar uma amostra feita homogénea (homogenato) de um tecido ou órgão (por exemplo, fígado) a repetidas centrifugações, aumentando de cada vez a velocidade angular. Hoje em dia esta técnica é largamente substituída pela centrifugação isopícnica. Esta técnica permite a separação de diferentes organelos celulares de eucariontes, como mitocôndrios, núcleo celulares e microssomas (resíduos do retículo endoplasmático).
Usando esta técnica, as partículas mais densas sedimentam primeiro; nas centrifugações subsequentes, as partículas de menor densidade sedimentam então.
Centrifugação isopícnica ou de equilíbrio
A centrifugação isopícnica, também chamada centrifugação de equilíbrio, é usada na separação de macromoléculas recorrendo a gradientes de concentração da solução base usada para a separação das partículas.
Uma das aplicações deste tipo de centrifugação é na separação de moléculas de DNA usando cloreto de césio (CsCl). É uma técnica sensível, capaz de separar moléculas de DNA de igual dimensão mas diferindo apenas na sua proporção AT/GC (proporção entre as bases adenina e timina e as bases guanina e citosina). Neste tipo de centrifugação, a amostra de DNA a separar é misturada com CsCl e posta a centrifugar a cerca de 10 000 g durante um prolongado período de tempo (tipicamente entre dois e três dias). O cloreto de césio é usado numa concentração em que toma uma densidade muito próxima da do DNA. Após este tempo, um gradiente de cloreto de césio será formado e o DNA separa-se segundo as suas proporções AT/GC em diferentes bandas ao longo do tubo.
Os gradientes de sacarose são utilizados na separação de partículas como organelos celulares e vírus, sendo uma alternativa à centrifugação diferencial. Nestes, um gradiente de densidade de sacarose é obtido adicionando cuidadosamente no tubo de centrífuga camadas de soluções de sacarose de diferentes concentrações, começando pela mais alta. Um gradiente típico usa 70% a 20% (p/v), com decrementos de 10%, mas estes valores dependem largamente da amostra a separar. A amostra é colocada no topo do tubo e ultracentrifugada. As partículas migram em direcção ao fundo do tubo e estacionam nas zonas do gradiente com densidade idêntica. A amostra assim dividida em diferentes camadas ao longo do tubo pode ser retirada aspirando cuidadosamente cada camada.
Uma modificação do gradiente de sacarose consiste na utilização de soluções de apenas 70% e 20%(p/v). A solução de 70% é depositada no fundo do tubo e a de 20% preenche o restante tubo; a amostra é também depositada no topo, migrando durante a centrifugação para a interface com a solução de 70%. Esta técnica permite a concentração de partículas de uma amostra sem que estas entrem em contacto com a parede do tubo, evitando um stress mecânico que muitas vezes provoca a desintegração dessas partículas.
Ultracentrifugação
O termo ultracentrifugação aplica-se à centrifugação que necessita de um tipo específico de centrífuga (ultracentrífuga). As velocidades alcançadas pelos rotores nestas centrífugas são muito elevadas, obtendo-se acelerações até 500 000 g. Neste tipo de centrífuga, a câmara onde se situa o rotor é refrigerada e encontra-se sob vácuo, para evitar o sobreaquecimento por atrito com o ar e para permitir que altas velocidades sejam atingidas.
A ultracentrifugação é usada para a sedimentação de macromoléculas; sob determinadas condições, acontece também uma distribuição não uniforme de moléculas de menores dimensões ao longo do tubo. A sedimentação depende da massa, forma e densidade das moléculas, bem como da densidade do solvente. O rotor e velocidade de rotação apropriados são usados dependendo da utilização.
É possível calcular o coeficiente de sedimentação (unidade: Svedberg, S) através da ultracentrifugação. Este coeficiente é proporcional à massa e à densidade da substância, dependendo também da forma das suas moléculas. Assim sendo, partículas de grande massa molecular e densidade sedimentam mais facilmente, enquanto que partículas com forma alongada sedimentam mais lentamente (devido ao maior atrito com o solvente). Uma aplicação clássica deste coeficiente é visível na classificação de subunidades dos ribossomas que, dependendo do seu tamanho, têm diferentes coeficientes de sedimentação: por exemplo, a subunidade pequena dos ribossomas bacterianos é chamada 16S e a sua sequência nucleotídica serve de base em estudos filogenéticos.
A ultracentrífuga foi inventada em 1925 por Theodor Svedberg, que ganhou o prémio Nobel da Química em 1926 pelo seu trabalho em sistemas coloidais, em que usou a sua invenção.
Em Astronáutica
As centrífugas humanas são usadas por agências de exploração espacial, como a NASA e a ESA, para o treino de astronautas. A NASA possui um equipamento que imprime uma aceleração de até 20 g aos indivíduos testados.
Este treino serve para testar a reacção e tolerância dos astronautas ao processo de descolagem dos vaivéns espaciais, em que elevadas forças são sentidas. Os astronautas são colocados nas extremidades do braço da centrífuga e sofrem uma acelerada rotação até atingir o desejado valor de g's.
Um tipo especial de centrífuga, chamada de raio curto (short radius centrifuge) é usada pela NASA no estudo do efeito terapêutico da força centrípeta aplicada a indivíduos sujeitos a períodos mais ou menos prolongados de microgravidade. Os indivíduos testados são sujeitos a um período de descanso que mimetiza condições de microgravidade e sujeitos durante curtos períodos a centrifugação (até 2,5 g). Este estudo pretende estabelecer uma terapêutica de combate aos efeitos nocivos do estágio prolongado na ausência da gravidade terrestre (atrofia muscular e descalcificação óssea), por exemplo na preparação de missões tripuladas a Marte.
Na indústria
Desenho de um rotor simples de aplicação industrial para a separação de sólidos e líquidos, semelhante ao tambor das máquinas de lavar roupa domésticas.
Separação isotópica
A centrifugação é usada em programas de desenvolvimento nuclear, para fins pacíficos ou bélicos, no enriquecimento de urânio.
O urânio tem dois isótopos principais, 235U e 238U. O gás hexafluoreto de urânio pode ser centrifugado de modo a separar os dois isótopos: o 238U é mais pesado e tende a depositar-se nas paredes da centrífuga, enquanto que o 235U é extraído do centro da mesma.
Concentração de sólidos
Em diversos tipos de indústria, é feita a concentração e secagem de sólidos que se encontram suspensos em solventes ou pastas. O sólido seco é geralmente denominado "torta". As centrífugas para este fim são normalmente construídas de modo a ter uma alimentação contínua da pasta a separar.
Um exemplo encontra-se no tratamento de águas residuais: as lamas resultantes do tratamento de águas residuais podem ser secas por centrifugação. Outras aplicações são a secagem de sal para comercialização e a purificação de reagentes químicos em larga escala.
Em casa
Máquina de lavar roupa.
A centrifugação é usada pelas máquinas de lavar roupa para retirar água em excesso da roupa. É por isso usada como um dos últimos passos num programa normal de lavagem. A água em excesso é escoada pelos orifícios do tambor da máquina, onde a roupa é retida.
Este princípio é também explorado nos secadores de salada, em que os legumes são colocados num cesto dentro de uma caixa, sendo o cesto girado manualmente com recurso a uma manivela. A água é escoada para fora do cesto via pequenos orifícios, assim como feito nas máquinas de lavar.
Princípio físico
É notório perceber que a maioria das explicações para o funcionamento das centrífugas figure em função da por muitos conhecida força centrífuga. Contudo é mais surpreendente perceber que tal explicação fundamenta-se em uma grandeza física sem realidade física, contudo: a chamada força centrífuga é uma pseudoforça ou força inercial, e por tal é fictícia, não existindo como força real, ou seja, como expressão da interação entre dois elementos físicos.
A compreensão do princípio de funcionamento das centrífugas passa antes portanto pela compreensão do que se denomina força inercial centrífuga e pela compreensão da não existência real de tal "força centrífuga", e a fim de evitar repetições de conteúdo, o leitor é dirigido ao artigo específico sobre o assunto.
Centrífugas ou centrifugadores
São equipamentos construídos de forma: colocando o recipiente contendo a amostra em movimento circular uniforme dotado de grande velocidade angular e raio apreciável. Objetiva submeter a amostra à situação em que uma grande força centrípeta é requerida à manutenção de sua trajetória.…
Em Biologia, Bioquímica e Química
A centrifugação é uma técnica fundamental usada em diversos ramos da Química, Biologia e Bioquímica para a separação de amostras. Em geral, estas são introduzidas em tubos de diferentes tamanhos, que são dispostos num motor de centrífuga. As centrífugas estão normalmente adaptadas para a utilização de diferentes tipos e tamanhos de rotores, conforme a velocidade e aplicação desejadas. Enquanto que microcentrífugas de bancada podem centrifugar tubos entre os 200 μL e os 2 mL de volume, centrífugas de grande porte podem usar tubos de volume muito variável, tipicamente até 1 L.
Separação de diferentes fases
Uma das aplicações mais frequentes da centrifugação é na separação de diferentes fases de uma amostra, em especial uma fase sólida de uma aquosa. Partículas insolúveis numa amostra sedimentam no fundo do tubo de centrífuga, restando o chamado sobrenadante (fase líquida) por cima do sedimento. O sobrenadante é então aspirado ou decantado e o sedimento retirado do tubo.
Esta técnica é usada, por exemplo, na separação de membranas celulares (insolúveis em água) e citoplasma (solvente celular aquoso) após ruptura de células. Também é usada para a separação dos elementos figurados do sangue e o plasma sanguíneo, em que as células (eritrócitos, leucócitos, plaquetas) são depositados no tubo, podendo o plasma ser separado e analisado.
Centrifugação diferencial
A centrifugação diferencial foi desenvolvida nos anos 60 do século XX por Christopher John Champerline e Juan Burdettee. Consiste em sujeitar uma amostra feita homogénea (homogenato) de um tecido ou órgão (por exemplo, fígado) a repetidas centrifugações, aumentando de cada vez a velocidade angular. Hoje em dia esta técnica é largamente substituída pela centrifugação isopícnica. Esta técnica permite a separação de diferentes organelos celulares de eucariontes, como mitocôndrios, núcleo celulares e microssomas (resíduos do retículo endoplasmático).
Usando esta técnica, as partículas mais densas sedimentam primeiro; nas centrifugações subsequentes, as partículas de menor densidade sedimentam então.
Centrifugação isopícnica ou de equilíbrio
A centrifugação isopícnica, também chamada centrifugação de equilíbrio, é usada na separação de macromoléculas recorrendo a gradientes de concentração da solução base usada para a separação das partículas.
Uma das aplicações deste tipo de centrifugação é na separação de moléculas de DNA usando cloreto de césio (CsCl). É uma técnica sensível, capaz de separar moléculas de DNA de igual dimensão mas diferindo apenas na sua proporção AT/GC (proporção entre as bases adenina e timina e as bases guanina e citosina). Neste tipo de centrifugação, a amostra de DNA a separar é misturada com CsCl e posta a centrifugar a cerca de 10 000 g durante um prolongado período de tempo (tipicamente entre dois e três dias). O cloreto de césio é usado numa concentração em que toma uma densidade muito próxima da do DNA. Após este tempo, um gradiente de cloreto de césio será formado e o DNA separa-se segundo as suas proporções AT/GC em diferentes bandas ao longo do tubo.
Os gradientes de sacarose são utilizados na separação de partículas como organelos celulares e vírus, sendo uma alternativa à centrifugação diferencial. Nestes, um gradiente de densidade de sacarose é obtido adicionando cuidadosamente no tubo de centrífuga camadas de soluções de sacarose de diferentes concentrações, começando pela mais alta. Um gradiente típico usa 70% a 20% (p/v), com decrementos de 10%, mas estes valores dependem largamente da amostra a separar. A amostra é colocada no topo do tubo e ultracentrifugada. As partículas migram em direcção ao fundo do tubo e estacionam nas zonas do gradiente com densidade idêntica. A amostra assim dividida em diferentes camadas ao longo do tubo pode ser retirada aspirando cuidadosamente cada camada.
Uma modificação do gradiente de sacarose consiste na utilização de soluções de apenas 70% e 20%(p/v). A solução de 70% é depositada no fundo do tubo e a de 20% preenche o restante tubo; a amostra é também depositada no topo, migrando durante a centrifugação para a interface com a solução de 70%. Esta técnica permite a concentração de partículas de uma amostra sem que estas entrem em contacto com a parede do tubo, evitando um stress mecânico que muitas vezes provoca a desintegração dessas partículas.
Ultracentrifugação
O termo ultracentrifugação aplica-se à centrifugação que necessita de um tipo específico de centrífuga (ultracentrífuga). As velocidades alcançadas pelos rotores nestas centrífugas são muito elevadas, obtendo-se acelerações até 500 000 g. Neste tipo de centrífuga, a câmara onde se situa o rotor é refrigerada e encontra-se sob vácuo, para evitar o sobreaquecimento por atrito com o ar e para permitir que altas velocidades sejam atingidas.
A ultracentrifugação é usada para a sedimentação de macromoléculas; sob determinadas condições, acontece também uma distribuição não uniforme de moléculas de menores dimensões ao longo do tubo. A sedimentação depende da massa, forma e densidade das moléculas, bem como da densidade do solvente. O rotor e velocidade de rotação apropriados são usados dependendo da utilização.
É possível calcular o coeficiente de sedimentação (unidade: Svedberg, S) através da ultracentrifugação. Este coeficiente é proporcional à massa e à densidade da substância, dependendo também da forma das suas moléculas. Assim sendo, partículas de grande massa molecular e densidade sedimentam mais facilmente, enquanto que partículas com forma alongada sedimentam mais lentamente (devido ao maior atrito com o solvente). Uma aplicação clássica deste coeficiente é visível na classificação de subunidades dos ribossomas que, dependendo do seu tamanho, têm diferentes coeficientes de sedimentação: por exemplo, a subunidade pequena dos ribossomas bacterianos é chamada 16S e a sua sequência nucleotídica serve de base em estudos filogenéticos.
A ultracentrífuga foi inventada em 1925 por Theodor Svedberg, que ganhou o prémio Nobel da Química em 1926 pelo seu trabalho em sistemas coloidais, em que usou a sua invenção.
Em Astronáutica
As centrífugas humanas são usadas por agências de exploração espacial, como a NASA e a ESA, para o treino de astronautas. A NASA possui um equipamento que imprime uma aceleração de até 20 g aos indivíduos testados.
Este treino serve para testar a reacção e tolerância dos astronautas ao processo de descolagem dos vaivéns espaciais, em que elevadas forças são sentidas. Os astronautas são colocados nas extremidades do braço da centrífuga e sofrem uma acelerada rotação até atingir o desejado valor de g's.
Um tipo especial de centrífuga, chamada de raio curto (short radius centrifuge) é usada pela NASA no estudo do efeito terapêutico da força centrípeta aplicada a indivíduos sujeitos a períodos mais ou menos prolongados de microgravidade. Os indivíduos testados são sujeitos a um período de descanso que mimetiza condições de microgravidade e sujeitos durante curtos períodos a centrifugação (até 2,5 g). Este estudo pretende estabelecer uma terapêutica de combate aos efeitos nocivos do estágio prolongado na ausência da gravidade terrestre (atrofia muscular e descalcificação óssea), por exemplo na preparação de missões tripuladas a Marte.
Na indústria
Desenho de um rotor simples de aplicação industrial para a separação de sólidos e líquidos, semelhante ao tambor das máquinas de lavar roupa domésticas.
Separação isotópica
A centrifugação é usada em programas de desenvolvimento nuclear, para fins pacíficos ou bélicos, no enriquecimento de urânio.
O urânio tem dois isótopos principais, 235U e 238U. O gás hexafluoreto de urânio pode ser centrifugado de modo a separar os dois isótopos: o 238U é mais pesado e tende a depositar-se nas paredes da centrífuga, enquanto que o 235U é extraído do centro da mesma.
Concentração de sólidos
Em diversos tipos de indústria, é feita a concentração e secagem de sólidos que se encontram suspensos em solventes ou pastas. O sólido seco é geralmente denominado "torta". As centrífugas para este fim são normalmente construídas de modo a ter uma alimentação contínua da pasta a separar.
Um exemplo encontra-se no tratamento de águas residuais: as lamas resultantes do tratamento de águas residuais podem ser secas por centrifugação. Outras aplicações são a secagem de sal para comercialização e a purificação de reagentes químicos em larga escala.
Em casa
Máquina de lavar roupa.
A centrifugação é usada pelas máquinas de lavar roupa para retirar água em excesso da roupa. É por isso usada como um dos últimos passos num programa normal de lavagem. A água em excesso é escoada pelos orifícios do tambor da máquina, onde a roupa é retida.
Este princípio é também explorado nos secadores de salada, em que os legumes são colocados num cesto dentro de uma caixa, sendo o cesto girado manualmente com recurso a uma manivela. A água é escoada para fora do cesto via pequenos orifícios, assim como feito nas máquinas de lavar.
Catação
Não muito usada. Use uma bacia com agua e coloque pedras e pedraços de vidro. Cate os pedações de vidro e tera somente pedras... Muito fácil.... Né :)
Decantação
A decantação é um processo de separação que permite separar misturas heterogêneas.
Utilizada principalmente em misturas bifásicas, como sólido-líquido (areia e água), sólido-gás (poeira-gás), líquido-líquido (água e óleo) e líquido-gás (vapor d’água e ar). Sendo esse processo fundamentado nas diferenças existentes entre as densidades dos componentes da mistura, e na espera pela sua decantação. A mistura é colocada em repouso num recipiente, de preferência fechado. Após a separação visual (fases), o processo pode ser feito através de vários métodos, que podem mudar o nome decantação por sifonação ou funil de decantação:
Decantação: separa-se um componente do outro através de um bastão de vidro, vertendo o líquido lentamente com a ajuda do bastão, até a substância menos densa passar para o outro recipiente. Este método evita que o líquido escorra para fora do recipiente, passando perfeitamente pelo bastão, e muito utilizado em separações de misturas sólido-líquido, como areia e água.
Funil de bromo ou funil de decantação: este método é usado para separar líquido-líquido, como óleo e água. O líquido mais denso passa controladamente através de uma válvula que é fechada imediatamente quando sua separação se completa, ou seja, antes que o líquido menos denso passe pela válvula e se misture novamente com o outro recipiente.
Sifonação: o recipiente que contém a mistura é colocado a uma altura superior do recipiente em que ocorrerá a separação e, através de um sifão, a substância menos densa é passada para o outro recipiente. Esse método só é possível se o sifão estiver completamente preenchido pelo líquido. Método muito utilizado também para esvaziar piscinas, aquários e transferir combustível de um recipiente para o outro.
Decantação sólido-líquido: Utiliza-se quando um componente sólido se encontra depositado no líquido.
Líquido-líquido: separam-se líquidos imiscíveis com densidades diferentes; o líquido mais denso acumula-se na parte inferior do sistema. Em laboratório usa-se o funil de bromo, também conhecido como funil de decantação, ou ainda, funil de separação. Num sistema formado por água e óleo, por exemplo, a água, por ser mais densa, localiza-se na parte inferior do funil e é escoada abrindo-se a torneira de modo controlado. A decantação pode ser feita de uma maneira mais rudimentar, utilizando-se um sifão (sifonação).
Exemplo: Coloque em um copo de água um pouco de areia. O resultado é um copo com agua suja. Deixe descançar um pouco e depois veja: a areia ficou embaixo por ser mais densa e a água ficou em cima por ser menos densa. Pergunta: A água ficou totalmente limpa; Resposta: Não totalmente, algo pode ter sido dissolvido na água.
Utilizada principalmente em misturas bifásicas, como sólido-líquido (areia e água), sólido-gás (poeira-gás), líquido-líquido (água e óleo) e líquido-gás (vapor d’água e ar). Sendo esse processo fundamentado nas diferenças existentes entre as densidades dos componentes da mistura, e na espera pela sua decantação. A mistura é colocada em repouso num recipiente, de preferência fechado. Após a separação visual (fases), o processo pode ser feito através de vários métodos, que podem mudar o nome decantação por sifonação ou funil de decantação:
Decantação: separa-se um componente do outro através de um bastão de vidro, vertendo o líquido lentamente com a ajuda do bastão, até a substância menos densa passar para o outro recipiente. Este método evita que o líquido escorra para fora do recipiente, passando perfeitamente pelo bastão, e muito utilizado em separações de misturas sólido-líquido, como areia e água.
Funil de bromo ou funil de decantação: este método é usado para separar líquido-líquido, como óleo e água. O líquido mais denso passa controladamente através de uma válvula que é fechada imediatamente quando sua separação se completa, ou seja, antes que o líquido menos denso passe pela válvula e se misture novamente com o outro recipiente.
Sifonação: o recipiente que contém a mistura é colocado a uma altura superior do recipiente em que ocorrerá a separação e, através de um sifão, a substância menos densa é passada para o outro recipiente. Esse método só é possível se o sifão estiver completamente preenchido pelo líquido. Método muito utilizado também para esvaziar piscinas, aquários e transferir combustível de um recipiente para o outro.
Decantação sólido-líquido: Utiliza-se quando um componente sólido se encontra depositado no líquido.
Líquido-líquido: separam-se líquidos imiscíveis com densidades diferentes; o líquido mais denso acumula-se na parte inferior do sistema. Em laboratório usa-se o funil de bromo, também conhecido como funil de decantação, ou ainda, funil de separação. Num sistema formado por água e óleo, por exemplo, a água, por ser mais densa, localiza-se na parte inferior do funil e é escoada abrindo-se a torneira de modo controlado. A decantação pode ser feita de uma maneira mais rudimentar, utilizando-se um sifão (sifonação).
Exemplo: Coloque em um copo de água um pouco de areia. O resultado é um copo com agua suja. Deixe descançar um pouco e depois veja: a areia ficou embaixo por ser mais densa e a água ficou em cima por ser menos densa. Pergunta: A água ficou totalmente limpa; Resposta: Não totalmente, algo pode ter sido dissolvido na água.
Química
Misturas
http://edificacoesnoem.blogspot.com.br/2013/03/misturas-quimica.html
Homogênia
http://edificacoesnoem.blogspot.com.br/2013/03/mistura-homogenia.html
Heterogênia
http://edificacoesnoem.blogspot.com.br/2013/03/mistura-heterogenia.html
Como Identifica-las
http://edificacoesnoem.blogspot.com.br/2013/03/identificando-misturas-homogenias-e.html
Misturas: Comum // Eutética // Azeotrópica
http://edificacoesnoem.blogspot.com.br/2013/03/misturas-comum-eutetica-azeotropica.html
http://edificacoesnoem.blogspot.com.br/2013/03/misturas-quimica.html
Homogênia
http://edificacoesnoem.blogspot.com.br/2013/03/mistura-homogenia.html
Heterogênia
http://edificacoesnoem.blogspot.com.br/2013/03/mistura-heterogenia.html
Como Identifica-las
http://edificacoesnoem.blogspot.com.br/2013/03/identificando-misturas-homogenias-e.html
Misturas: Comum // Eutética // Azeotrópica
http://edificacoesnoem.blogspot.com.br/2013/03/misturas-comum-eutetica-azeotropica.html
Misturas: Comum - Eutética - Azeotrópica
Mistura Comum, Eutética e Azeotrópica
Quando a curva apresenta variação nos dois pontos (PF e PE), dizemos que é uma mistura comum. Quando um, e apenas um dos pontos apresenta variação, essa mistura receberá um nome especial.
Resumindo:
Quando a curva apresenta variação nos dois pontos (PF e PE), dizemos que é uma mistura comum. Quando um, e apenas um dos pontos apresenta variação, essa mistura receberá um nome especial.
- PF varia e PE constante: mistura azeotrópica
- PF constante e PE varia: mistura eutética
Resumindo:
Identificando Misturas Homogênias e Heterogênias
Misturas heterogêneas são facilmente identificáveis já que, na maioria das vezes, visualmente reconhecemos mais de uma fase. Mas e nas misturas homogêneas? Como podemos saber se uma amostra é pura ou uma mistura?
A resposta para isso é a curva de aquecimento.
Curva de aquecimento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida ou resfriada, incluindo-se as mudanças de estado físico.
Sabemos que durante uma mudança de estado físico a temperatura permanece constante (Q=mL) e que, durante o aquecimento sem mudança de estado, sua variação é linear ( ). Assim, a curva acima é característica, mostrando dois patamares, um no ponto de fusão (PF) e outro no ponto de ebulição (PE).
). Assim, a curva acima é característica, mostrando dois patamares, um no ponto de fusão (PF) e outro no ponto de ebulição (PE).
Levantando experimentalmente a curva de aquecimento de uma amostra, quatro coisas podem acontecer:
A resposta para isso é a curva de aquecimento.
Curva de aquecimento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida ou resfriada, incluindo-se as mudanças de estado físico.
 ). Assim, a curva acima é característica, mostrando dois patamares, um no ponto de fusão (PF) e outro no ponto de ebulição (PE).
). Assim, a curva acima é característica, mostrando dois patamares, um no ponto de fusão (PF) e outro no ponto de ebulição (PE).Levantando experimentalmente a curva de aquecimento de uma amostra, quatro coisas podem acontecer:
- A curva apresenta temperatura constante no ponto de fusão e de ebulição;
- A curva apresenta variação de temperatura no ponto de fusão e de ebulição;
- A curva apresenta variação de temperatura apenas no ponto de fusão e no de ebulição permanece constante;
- A curva apresenta temperatura constante no ponto de fusão e variação de temperatura no de ebulição.
Mistura Heterogênia
São aquelas formadas por mais de uma fase. Nelas conseguimos distinguir mais de um componente. Água e óleo, ar e poeira, são exemplos de misturas heterogêneas.
Mistura Homogênia
São aquelas cujos componentes não conseguimos distinguir. Ela é perfeitamente uniforme, portanto monofásica. O ar atmosférico e a água do mar são exemplos de misturas homogêneas.
Misturas: Química
Misturas: como sabemos, são constituídas por mais de uma substância. O ar atmosférico, a água do mar, e até água mineral são misturas. Em nosso dia a dia lidamos muito mais com misturas do que com substâncias puras, mesmo que nem saibamos que algumas o são.
Para entendermos melhor essa questão, é importante conhecermos o conceito de fase, bastante simples e intuitivo. Quando olhamos para uma amostra e conseguimos detectar uma porção uniforme, com características iguais em toda sua extensão, detectamos uma fase. Pense em um copo contendo água do mar. Embora saibamos que se trata de uma mistura, não percebemos qualquer diferença na amostra, ou seja, ela possui apenas uma fase.
Pense agora em um copo contendo água e óleo. Você sabe que eles não se misturam e facilmente identificamos uma porção com água e uma com óleo. Esse sistema (amostra) possui duas fases. Importante: Fases não estão ligadas ao estado físico. Você pode, como no exemplo da água e óleo, ter duas fases líquidas no mesmo sistema.
Para entendermos melhor essa questão, é importante conhecermos o conceito de fase, bastante simples e intuitivo. Quando olhamos para uma amostra e conseguimos detectar uma porção uniforme, com características iguais em toda sua extensão, detectamos uma fase. Pense em um copo contendo água do mar. Embora saibamos que se trata de uma mistura, não percebemos qualquer diferença na amostra, ou seja, ela possui apenas uma fase.
Pense agora em um copo contendo água e óleo. Você sabe que eles não se misturam e facilmente identificamos uma porção com água e uma com óleo. Esse sistema (amostra) possui duas fases. Importante: Fases não estão ligadas ao estado físico. Você pode, como no exemplo da água e óleo, ter duas fases líquidas no mesmo sistema.
Mito
Um mito (do grego antigo μυθος, translit. "mithós") é uma narrativa de caráter simbólico, relacionada a uma dada cultura. O mito procura explicar a realidade, os fenômenos naturais, as origens do Mundo e do homem por meio de deuses, semi-deuses e heróis.
Ao mito está associado o rito. O rito é o modo de se pôr em ação o mito na vida do homem - em cerimônias, danças, orações e sacrifícios.
O termo "mito" é, por vezes, utilizado de forma pejorativa para se referir às crenças comuns (consideradas sem fundamento objetivo ou científico, e vistas apenas como histórias de um universo puramente maravilhoso) de diversas comunidades. No entanto, até acontecimentos históricos se podem transformar em mitos, se adquirem uma determinada carga simbólica para uma dada cultura. Na maioria das vezes, o termo refere-se especificamente aos relatos das civilizações antigas que, organizados, constituem uma mitologia - por exemplo, a mitologia grega e a mitologia romana.
Ao mito está associado o rito. O rito é o modo de se pôr em ação o mito na vida do homem - em cerimônias, danças, orações e sacrifícios.
O termo "mito" é, por vezes, utilizado de forma pejorativa para se referir às crenças comuns (consideradas sem fundamento objetivo ou científico, e vistas apenas como histórias de um universo puramente maravilhoso) de diversas comunidades. No entanto, até acontecimentos históricos se podem transformar em mitos, se adquirem uma determinada carga simbólica para uma dada cultura. Na maioria das vezes, o termo refere-se especificamente aos relatos das civilizações antigas que, organizados, constituem uma mitologia - por exemplo, a mitologia grega e a mitologia romana.
Assinar:
Postagens (Atom)




