O movimento térmico de uma molécula de líquido deve ser suficiente para vencer a tensão superficial e evaporar, isto é, sua energia cinética deve exceder o trabalho de coesão aplicado pela tensão superficial à superfície do líquido. Por isso, a evaporação acontece mais rapidamente a altas temperaturas, a altas vazões entre as fases líquida e vapor e em líquidos com baixas tensões superficiais (isto é, com pressões de vapor mais elevadas).
Como apenas uma proporção pequena de moléculas está localizada perto da superfície e movendo-se na direção correta para escapar do líquido em um certo instante, a taxa de evaporação é limitada. Além disso, como as moléculas de maior energia escapam e as que ficam têm menor energia cinética média, a temperatura do líquido diminui. Este fenômeno também é chamado de resfriamento evaporativo. Um exemplo para tal fenômeno é a transpiração (suor). A evaporação promove resfriamento porque consome calor sensível e o transforma em calor latente, consumindo, no caso da água, cerca de 600 calorias por grama (600 Kilocalorias por quilo) de água evaporada (inversamente, durante a condensação da água, ocorre a recuperação do calor sensível - também 600 calorias por grama).
Equilíbrio Evaporativo
Se a evaporação ocorrer em um recipiente fechado, as moléculas que escapam do líquido acumulam-se na forma de vapor acima do líquido. Muitas dessas moléculas, aliás, retornam ao líquido. Quando o processo de escape e retorno alcança um equilíbrio, o vapor é chamado de saturado, e não ocorrem mudanças adicionais na pressão de vapor ou na temperatura do líquido.
[editar] Evaporação da água
É um erro dizer que somente existe vapor d'água a 100 °C a 1 atm. As moléculas de água estão em um estado constante de evaporação e condensação perto da superfície da água líquida.[2] Se uma molécula na superfície da água recebe energia suficiente, ela deixará o líquido, com formação de vapor a uma certa pressão. A uma pressão de vapor de 1 atm, a água acaba fervendo, e isto ocorre a 100 °C.A razão entre a perda de calor de uma superfície de água por evaporação e a perda de calor devido à convecção, independente da velocidade do vento, é dada por:[3]
 é a perda de calor de uma superfície de água por convecção em W/(m²•K),
é a perda de calor de uma superfície de água por convecção em W/(m²•K), 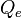 é a perda de calor de uma superfície de água por evaporação em W/(m²•K),
é a perda de calor de uma superfície de água por evaporação em W/(m²•K),  e
e  são as temperaturas da água e do ar em Kelvin (ou Celsius) e
são as temperaturas da água e do ar em Kelvin (ou Celsius) e  e
e  são as pressões do vapor da superfície da água e do ar e
são as pressões do vapor da superfície da água e do ar e 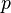 é a pressão barométrica, com todas pressões em mmHg (Bowen, 1926).
é a pressão barométrica, com todas pressões em mmHg (Bowen, 1926).

Nenhum comentário:
Postar um comentário